Percorso Diagnostico Terapeutico Assistenziale per i Tumori Eredo-Familiari Mammella – Ovaio
Ridefinizione del percorso di cura dei tumori eredo-familiari mammella-ovaio nell’Azienda Ospedaliera Universitaria Sant’Andrea di Roma
Abstract
Il Percorso Diagnostico Terapeutico Assistenziale (PDTA) è il principale strumento per disegnare e strutturare i processi assistenziali ed organizzativi basato sui bisogni dell’utenza. Questi percorsi, vengono costruiti in un ambito multidisciplinare sia aziendale che territoriale e sono degli interventi complessi, mirati alla condivisione dei processi decisionali e all’organizzazione dell’assistenza, dalla diagnosi al follow-up, per una categoria specifica di soggetti.. Numerose sono le evidenze scientifiche sul valore del PDTA in area oncologica, tuttavia, spesso in ambitonazionale è presente un’offerta disomogenea, e per quanto riguarda i PDTA dedicati ai soggetti ad alto rischio eredo-familiare di tumore della mammella e/o ovaio anche fortemente lacunosa.. Nonostante l’inclusione nei macro-obiettivi del Piano Nazionale di Prevenzione 2014-2018 della gestione del rischio eredo-familiare per tumore della mammella, sono poche le regioni che hanno integrato PDTA dedicati ai tumori eredo-familiari nei programmi di screening.
Nell’Azienda Ospedaliera Universitaria (AOU) Sant’Andrea di Roma è in corso di approvazione un PDTA dedicato ai tumori eredo-familiari mammella/ovaio in cui, a partire dal setting assistenziale già in essere, viene ridisegnato e codificato il percorso di presa in carico di soggetti ad alto rischio oncologico su base eredo-familiare. L’obiettivo finale è garantire una medicina personalizzata, che tenga conto dei bisogni del singolo individuo, al fine di ottenere una migliore sopravvivenza e il mantenimento di una soddisfacente qualità di vita. Nel documento viene definita la struttura organizzativa, i ruoli e le responsabilità dei diversi professionisti coinvolti nella gestione del rischio oncologico, con lo scopo di innovare l’organizzazione e migliorare la pratica clinico-assistenziale.
Introduzione
Il rischio di ammalare di carcinoma della mammella aumenta con l’aumentare dell’età, con una probabilità di sviluppo di cancro al seno del 2,4% fino a 49 anni (1 donna su 42), del 5,5% tra 50 e 69 anni (1 donna su 18) e del 4,7% tra 70 e 84 (1 donna su 21). È la neoplasia a più alta incidenza nel sesso femminile, e in Italia sono state stimate per il 2020 54.976 nuove diagnosi (il 30,3% di tutti i tumori femminili). (dati AIRTUM) [1]. La maggior parte dei tumori della mammella è sporadico, mentre il 5-10% è ereditario [6] e i geni di suscettibilità principalmente coinvolti nelle forme ereditarie sono BRCA1 (MIM # 604370) e BRCA2 (MIM # 600185) [2,3,4]. I portatori (carriers) di varianti patogenetiche in questi geni ereditano, con modalità autosomica dominante, una maggiore predisposizione all'insorgenza di tumori della mammella/ovaio, rispetto alla popolazione generale. Ogni individuo portatore di varianti patogenetiche nei geni BRCA ha una probabilità del 50%, indipendentemente dal sesso, di trasmettere ai propri figli il gene mutato e di conseguenza un rischio oncologico aumentato. In particolare, donne portatrici di varianti patogenetiche nei geni BRCA1/2 hanno un rischio cumulativo di cancro della mammella entro i 70 anni del 57% per BRCA1 e del 49% per BRCA2, mentre il rischio di sviluppare un tumore ovarico è del 40% per BRCA1 e del 18% per BRCA2 [5, 6]. Nel corso degli ultimi anni, grazie alle nuove tecniche di sequenziamento genico e allo studio dei meccanismi patogenetici alla base dei tumori ereditari sono stati identificati, oltre ai geni BRCA1/2, altri geni coinvolti nelle forme ereditarie di tumore della mammella/ovaio, tra i quali geni coinvolti nel controllo del ciclo cellulare, nella risposta al danno al DNA, nei processi di riparazione delle rotture del DNA mediante ricombinazione omologa (HR). A differenza di BRCA1/2, che si definiscono ad alta penetranza, questi geni presentano mutazioni molto più rare e, in alcuni casi, conferiscono rischi oncologici inferiori [7]. L’identificazione dei soggetti portatori di varianti patogenetiche dei geni BRCA, o di altri geni predisponenti, rappresenta un importante opportunità da considerare in ambito di sanità pubblica in quanto offre la possibilità di mettere in atto strategie di prevenzione personalizzate per la riduzione del rischio oncologico.
L’inserimento nella pratica clinica di un test genetico in grado di identificare i soggetti ad alto rischio oncologico ereditario rende necessario che, in tutte le strutture che lo erogano, venga codificato un percorso diagnostico, assistenziale e terapeutico in grado di affrontare in modo adeguato le problematiche relative alla gestione del rischio genetico, della diagnosi e della presa in carico, sia degli individui che delle famiglie ad alto rischio. In Italia, esistono forti disomogeneità territoriali e regionali che spesso comportano gestioni cliniche inappropriate, frammentate e inutilmente costose, con gravi conseguenze sulla salute delle donne.
La Regione Emilia-Romagna per prima, con Delibera di Giunta Regionale n. 1035/2009 e successiva attivazione nel 2012, ha avviato un percorso regionale per l’individuazione e la sorveglianza del rischio eredo-familiare rivolto alle donne, secondo il modello di Hub e Spoke [8]. In successione, solo altre 7 regioni (Sicilia, Campania, Liguria, Veneto, Abruzzo, Toscana, Marche) hanno approvato PDTA dedicati ai tumori ereditari e solo alcune hanno deliberato anche l’esenzione dal pagamento del ticket per le prestazioni sanitarie previste dai protocolli di sorveglianza. La maggior parte dei PDTA presenti in Italia ad oggi sono organizzati all’interno di reti oncologiche regionali e solo l’AOU Federico II di Napoli ha recepito a livello aziendale il PDTA regionale, con l’istituzione di Gruppo Oncologico Multidisciplinare (GOM) finalizzato alla gestione del PDTA per i tumori eredo-familiari della mammella, dell’ovaio e del colon-retto.
Nella regione Lazio, nel 2017, sono state approvate le linee di indirizzo per la “prevenzione secondaria del tumore al seno, gestione delle donne ad alto rischio e follow up delle donne post trattamento” (DCA 52/2017) [9], dove vengono stabiliti i criteri di definizione del rischio ereditario oncologico e gli indirizzi per la sorveglianza delle donne ad alto rischio. Sulla base di questo documento e tenendo conto del ciclo di Deming (analisi, riprogettazione, gestione del cambiamento e monitoraggio) come modello di miglioramento continuo di qualità [10], nell’AOU Sant’Andrea di Roma, è stata avviata la ridefinizione del percorso di cura dei tumori eredo-familiari mammella-ovaio mediante la redazione di un PDTA che ha lo scopo di:
- Garantire ai soggetti con varianti patogenetiche nei geni BRCA1 e BRCA2 e in altri geni di predisposizione un’efficace presa in carico multidisciplinare, secondo le migliori e più aggiornate evidenze disponibili (LG).
- Razionalizzare e rendere omogeneo il percorso diagnostico e terapeutico aziendale.
- Migliorare e facilitare l’accesso ai servizi di diagnosi e cura.
- Uniformare le procedure tra le UU.OO. che all’interno dell’Azienda partecipano al percorso.
- Ottimizzare la qualità delle cure prestate, in coerenza con le linee guida basate sulle prove di efficacia disponibili.
- Perfezionare gli aspetti informativi e comunicativi dei soggetti interessati.
- Monitorare la qualità dei trattamenti attraverso l’identificazione, la raccolta e l’analisi di indicatori di processo e di esito.
- Consolidare la continuità dell’assistenza.
- Offrire un percorso integrato e di qualità che garantisca la presa in carico assistenziale dei soggetti interessati, che riduca e standardizzi i tempi dell’iter diagnostico-terapeutico, fissando gli standard aziendali.
Metodi e materiali
La costruzione del PDTA ha seguito lo schema generale dei Progetti Miglioramento Continuo di Qualità (MCQ). Nell’ottica di ottimizzare e migliorare le risposte ai bisogni di salute dei soggetti ad alto rischio di tumore ereditario, senza disomogeneità di cura e trattamento, è stato costituito un Gruppo di Lavoro Aziendale Multidisciplinare (GLAM) per la redazione del PDTA. Il GLAM, in via preliminare, ha analizzato le attività e le procedure già in essere nella AOU e ha individuato la migliore sequenza di azioni da intraprendere, al fine di raggiungere gli obiettivi prefissati della domanda di salute specifica. Le informazioni relative alla gestione del rischio oncologico dei portatori di varianti patogenetiche di geni BRCA hanno consentito di costruire il PDTA contestualizzando le azioni di cambiamento nella realtà assistenziale della AOU Sant’Andrea. Le UU OO coinvolte nel processo di cura sono: la UOC Genetica Medica e Diagnostica Cellulare Avanzata, la UOC Oncologia, la UOS Radiologia senologica, la UOS Diagnosi e Terapia Senologica, la UOC Ginecologia, la UOD Chirurgia Senologica, la UOC Anatomia Patologica Morfologica e Molecolare, la UOC Radioterapia, la UOD Psiconcologia. La sequenza delle attività svolte nel PDTA è stata pianificata con l’obiettivo di ottimizzare i tempi e le risorse, mediante la costruzione di un processo di cura articolato e integrato nei suoi diversi passaggi da una unità operativa all’altra, al fine di assicurare la continuità assistenziale e la difformità di gestione.
Per la redazione delle varie fasi del PDTA sono state utilizzate le seguenti normative, linee guida e di indirizzo nazionali e internazionali:
- DCA N.U000189/2017. Programma Operativo 2016-2018 (DCA 52/2017) Approvazione documento di indirizzo per la prevenzione secondaria del tumore al seno, gestione delle donne ad alto rischio e follow-up delle donne post-trattamento
- DCA U00191/2015: Approvazione dei Programmi di screening oncologici nella Regione Lazio
- DCA 549/ 2015 Istituzione della rete specialistica disciplinare dei Laboratori di Genetica Medica in attuazione dei Programmi Operativi 2013-2015. Approvazione del documento relativo alla "rete dei laboratori di Genetica Medica della Regione Lazio".
- Condizioni minime per la consulenza genetica in oncologia. Bianchi-Scarrà G, Genuardi M, Pasini B, Tibiletti MG, Varesco L (sottogruppo SIGUONC settembre 2000).
- Il sequenziamento del DNA di nuova generazione: indicazioni per l’impiego clinico-Documento Commissione SIGU-NGS. Versione gennaio 2016.
- L’interpretazione delle varianti di sequenza in geni di predisposizione a tumori: indicazioni operative per il laboratorio diagnostico. Documento SIGU, 10 marzo 2016
- NCCN guidelines, Genetic/Familial High-Risk Assessment: Breast and Ovarian, 2020
- Raccomandazioni per l’implementazione del test BRCA nelle pazienti con carcinoma ovarico e nei familiari a rischio elevato di neoplasia. A cura del Gruppo di Lavoro AIOM - SIGU - SIBIOC - SIAPEC-IAP. V.2-gennaio 2019
Per descrivere il PDTA sono stati utilizzati diagrammi di flusso che hanno permesso la visione globale dell’intero percorso e l’identificazione delle attività o dell’insieme delle attività maggiormente significative. In Tabella 1 sono riassunte tutte le fasi che hanno portato alla redazione del PDTA.
|
Destinatari del PDTA
|
Il PDTA è centrato sui bisogni degli individui considerati ad alto rischio per tumore eredo-familiare mammella/ovaio |
| Costituzione del gruppo di lavoro operativo aziendale | Il gruppo di lavoro con valenza multidisciplinare è stato costituito coinvolgendo tutte le professionalità già operative nella AOU nello specifico processo di cura. |
| Identificazione delle UU OO coinvolte nel processo di cura | UOC Genetica Medica e Diagnostica Cellulare Avanzata, UOC Oncologia, UOS Radiologia senologica, UOS Diagnosi e Terapia Senologica, UOC Ginecologia, UOD Chirurgia Senologica, UOC Anatomia Patologica Morfologica e Molecolare, UOC Radioterapia, UOD |
| Psiconcologia | |
| Identificazione dei coordinatori del percorso | Vengono identificati un coordinatore per la gestione della diagnosi genetico-molecolare e un coordinatore clinico per la gestione dei percorsi di sorveglianza/riduzione del rischio. |
| Condivisione delle linee guida e di indirizzo per la costruzione del percorso | Sono state stabilite le raccomandazioni per la pratica clinica presenti in letteratura da utilizzare nel disegno del PDTA, adattate alla realtà organizzativa aziendale in termini di risorse umane, tecnologiche, organizzative, economiche. |
| Redazione del percorso di cura | Sono stati stabiliti gli obiettivi da raggiungere e ridefinite le varie fasi del processo |
| Elaborazione e costruzione dei percorsi specifici | I percorsi di sorveglianza/riduzione del rischio oncologico sono stati schematizzati in flow-chart specifiche |
| Costruzione delle matrici di responsabilità | Per ogni singolo episodio clinico-assistenziale-organizzativo sono state descritte tutte le attività, azioni, risorse che lo caratterizzano. Su questa base è stata costruita la matrice analitica delle responsabilità. |
| Scelta degli indicatori di esito e di processo per il monitoraggio del percorso | Sono stati scelti degli indicatori specifici per ogni fase del percorso. Il monitoraggio effettuato attraverso la rilevazione ed analisi annuale degli indicatori è mirato all’attuazione di eventuali azioni correttive e migliorative del percorso. |
Tabella 1
Risultati
Il percorso assistenziale è articolato in tre fasi principali: Valutazione del rischio oncologico, Comunicazione del rischio, Presa in carico del soggetto ad alto rischio oncologico ereditario in percorsi di sorveglianza/riduzione del rischio (Fig. 1).
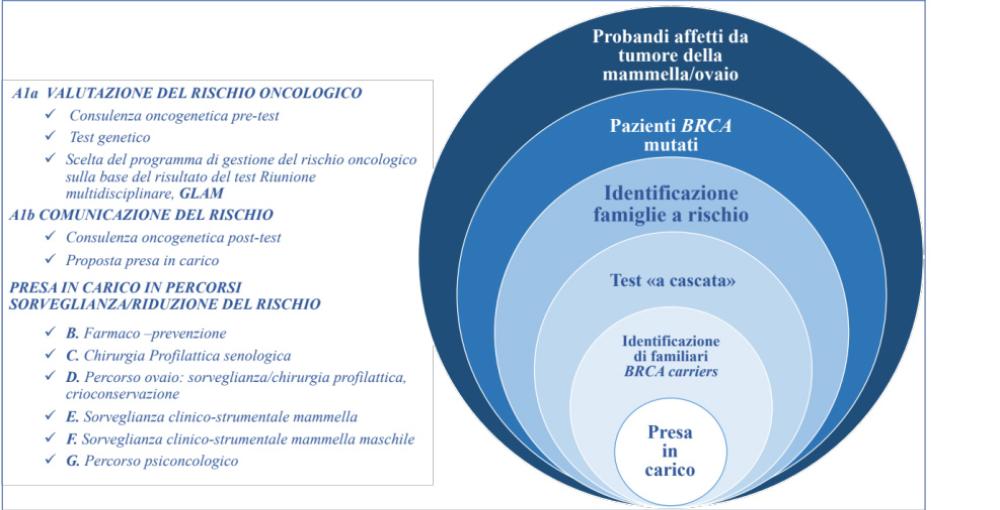
La prima valutazione del rischio eredo-familiare viene effettuata dai MMG e da tutti gli operatori di primo contatto. I soggetti a potenziale rischio ereditario di sviluppare tumore della mammella e/o ovaio vengono reclutati mediante la somministrazione di un questionario (“Programma Operativo 2016-2018 (DCU000A52/2017)” [3].
Da tale valutazione si possono delineare due percorsi: un invio agli specialisti di riferimento per una valutazione più approfondita del rischio, mediante lo strumento di predizione IBIS (http://www.ems-trials.org/riskevaluator/), o l’invio diretto alla consulenza oncogenetica (CGO) [11], che rappresenta la porta d’ingresso al PDTA (Fig.2, A1a, AV1).
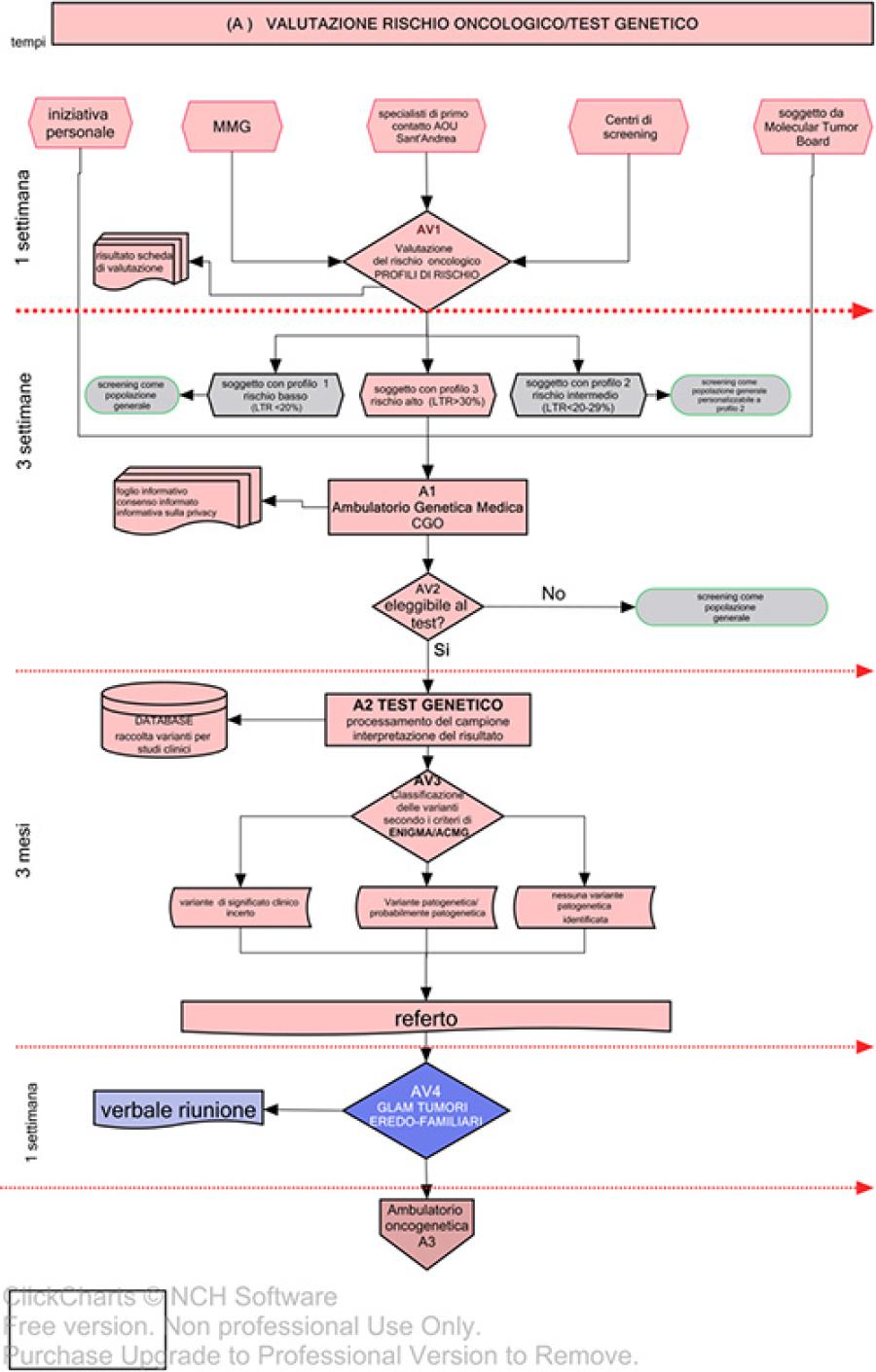
Lo strumento di predizione IBIS permette, sulla base della stima di sviluppare nel corso della vita un tumore della mammella (Life Time Risk-LTR), di identificare tre livelli di rischio: Profilo 1, rischio basso, livello di rischio oncologico equivalente a quello della popolazione generale (LTR< 20%); Profilo 2, rischio intermedio: rischio oncologico > 2 (LTR 20-29%). Profilo 3, rischio alto: rischio oncologico > 3 superiore (LTR>30%). I soggetti con profilo di rischio 3 verranno indirizzati alla CGO (Fig.2, A1a, A1), dove viene valutato se esiste un rischio aumentato di sviluppare alcuni specifici tumori, associato alla presenza di mutazioni nei geni BRCA1/2 o altri geni di predisposizione. In questo caso viene proposto il test genetico. L’eleggibilità del soggetto al test viene effettuata mediante l’utilizzo di criteri tabellari, definiti dal DCA52/2017 della Regione Lazio [9]. Il test genetico viene eseguito nel Laboratorio di Genetica Medica aziendale, configurato come Laboratorio di II Livello, sul DCA del 18 novembre 2015, n. U00549 [12]. Il significato del test genetico può assumere implicazioni diverse a seconda se il soggetto esaminato sia affetto (test diagnostico), familiare non affetto (test predittivo) o parente con tumore ovarico di alto grado (test predittivo di efficacia alle terapie antitumorali). In casi specifici può essere valutata la possibilità di un approfondimento diagnostico, con la proposta di un test genetico per altri geni implicati nello sviluppo di tumori della mammella/ovaio [13]. Il test genetico può risultare informativo (variante patogenetica identificata in soggetto affetto/non affetto; negativo, in familiare di soggetto portatore di variante patogenetica) o non informativo (test negativo o identificazione di variante di significato clinico incerto).
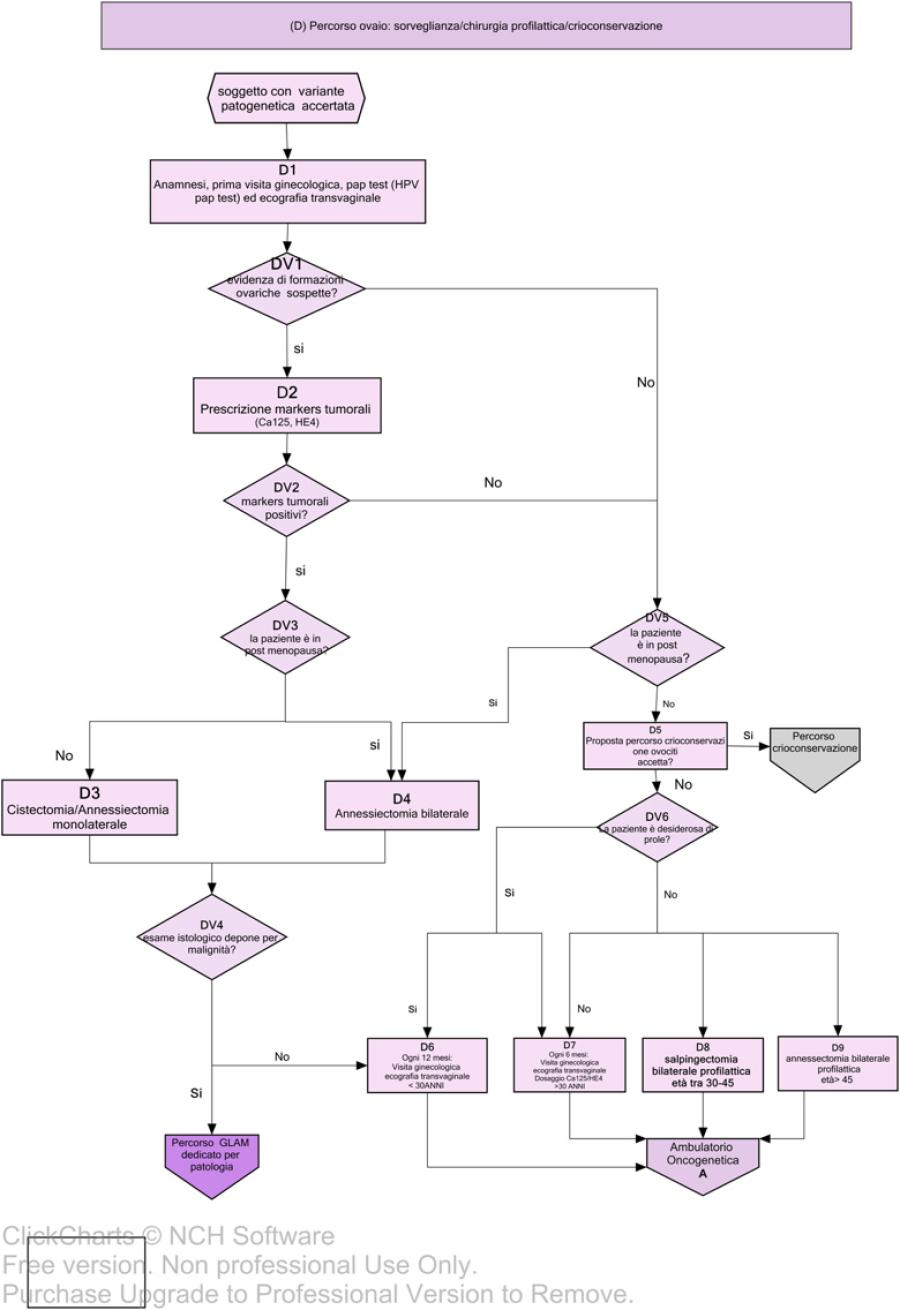
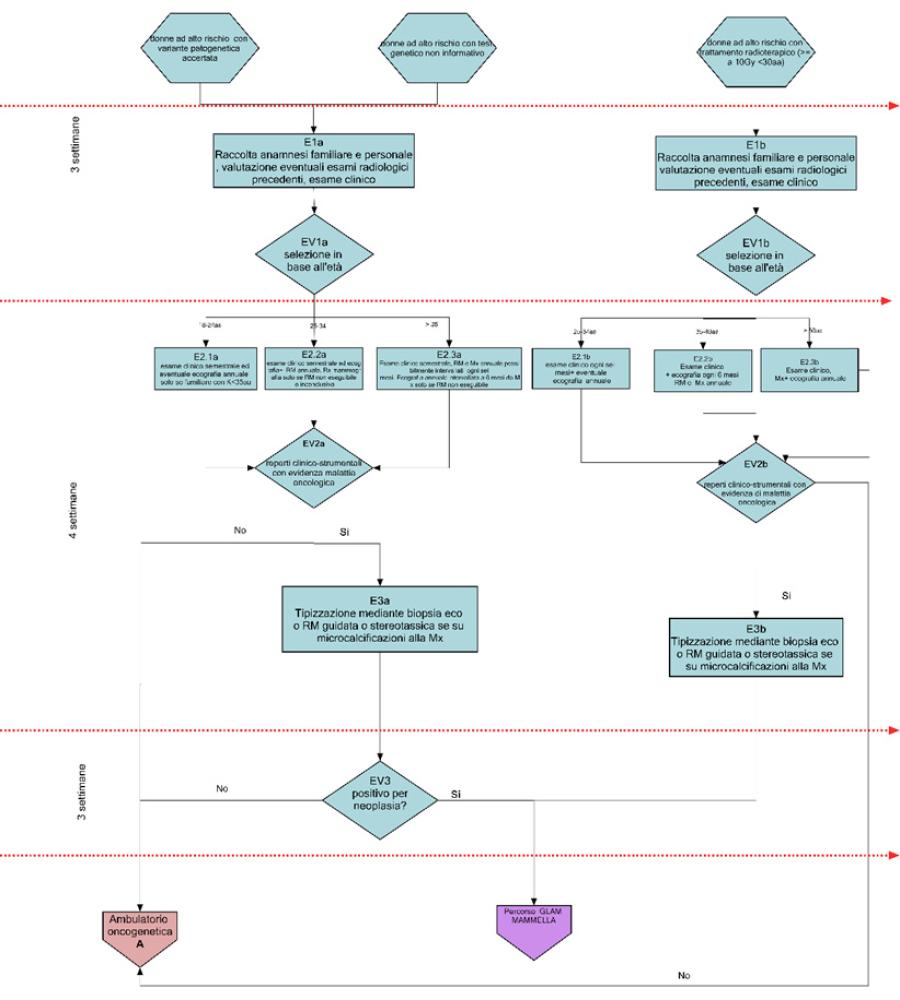
Il risultato del test genetico viene discusso dal Gruppo di Lavoro Aziendale Multidisciplinare (GLAM) costituito da tutte le figure professionali coinvolte nel processo di cura (Fig.2, A1a, AV4). Sulla base del risultato del test viene effettuata una valutazione multidisciplinare al fine di identificare un percorso personalizzato di sorveglianza/riduzione del rischio oncologico (Fig.3, Fig. 4).
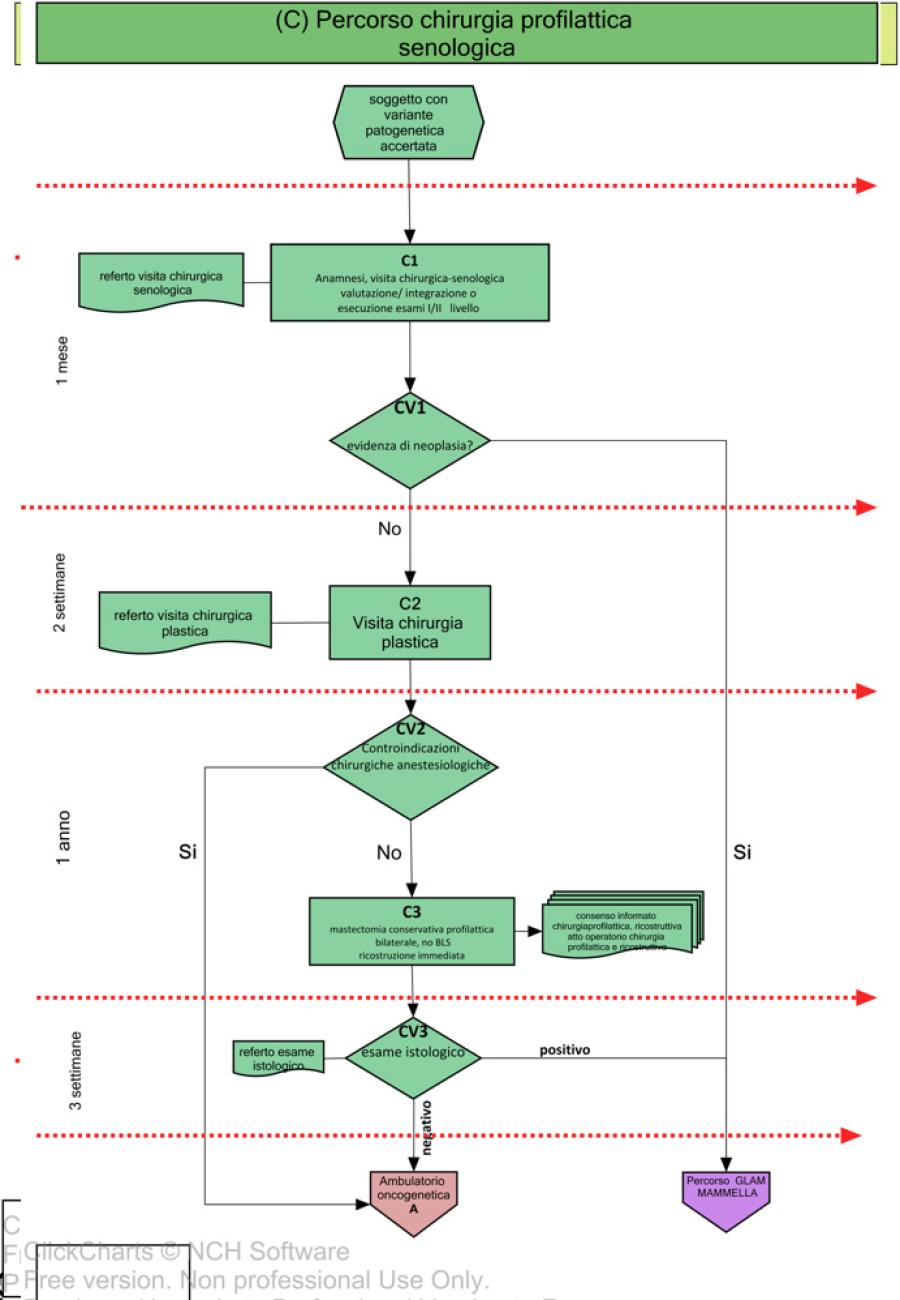
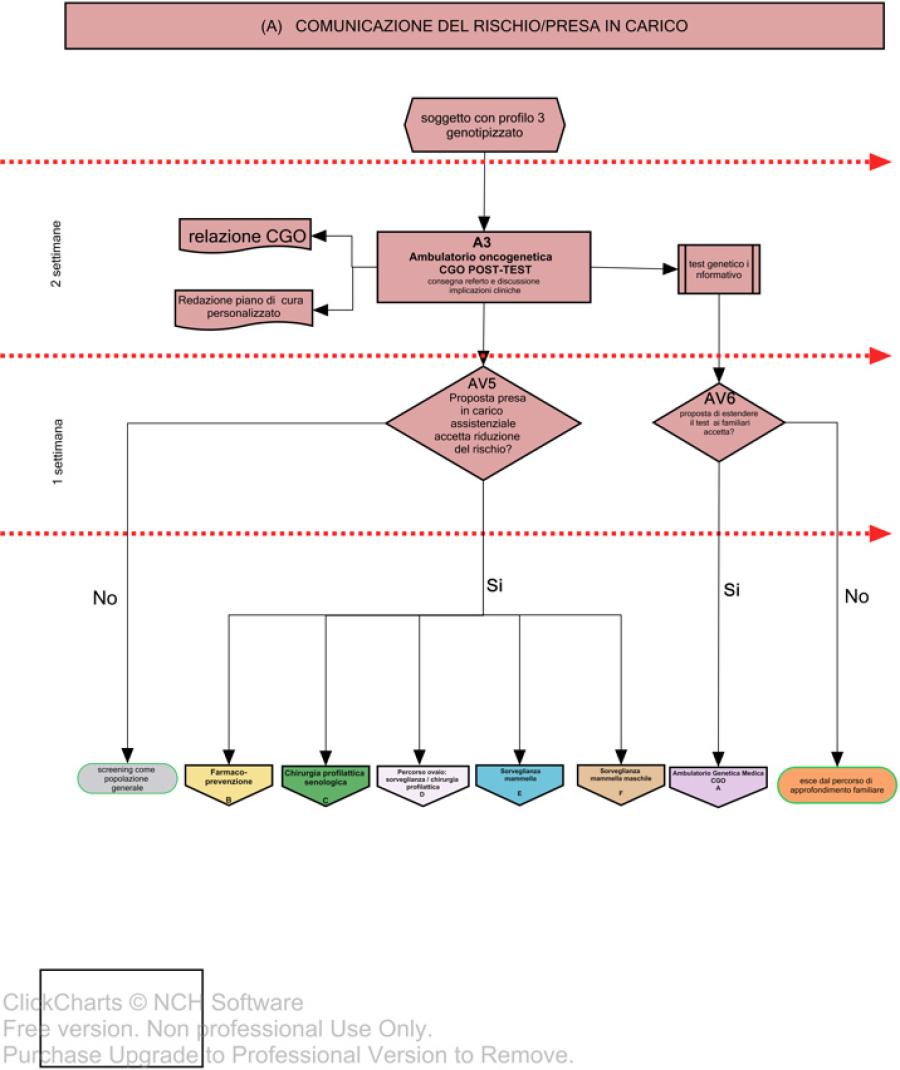
La comunicazione del rischio oncologico e il percorso personalizzato stabilito nella riunione multidisciplinare del GLAM verrà proposto al soggetto ad alto rischio in sede di Consulenza Oncogenetica Post-test (Fig. 3, A3, AV5).
In caso di test informativo, durante la CGO post-test, oltre all’informazione sulla pianificazione del processo di cura, il soggetto portatore di variante patogenetica verrà informato sulle implicazioni cliniche a livello familiare e verrà proposto il “test a cascata”. L’analisi genetica nei familiari consentirà di confermare/escludere lo stato di portatore ed identificare i soggetti ad alto rischio, che avranno la possibilità di essere inseriti nei programmi di sorveglianza/riduzione del rischio (Fig.1).
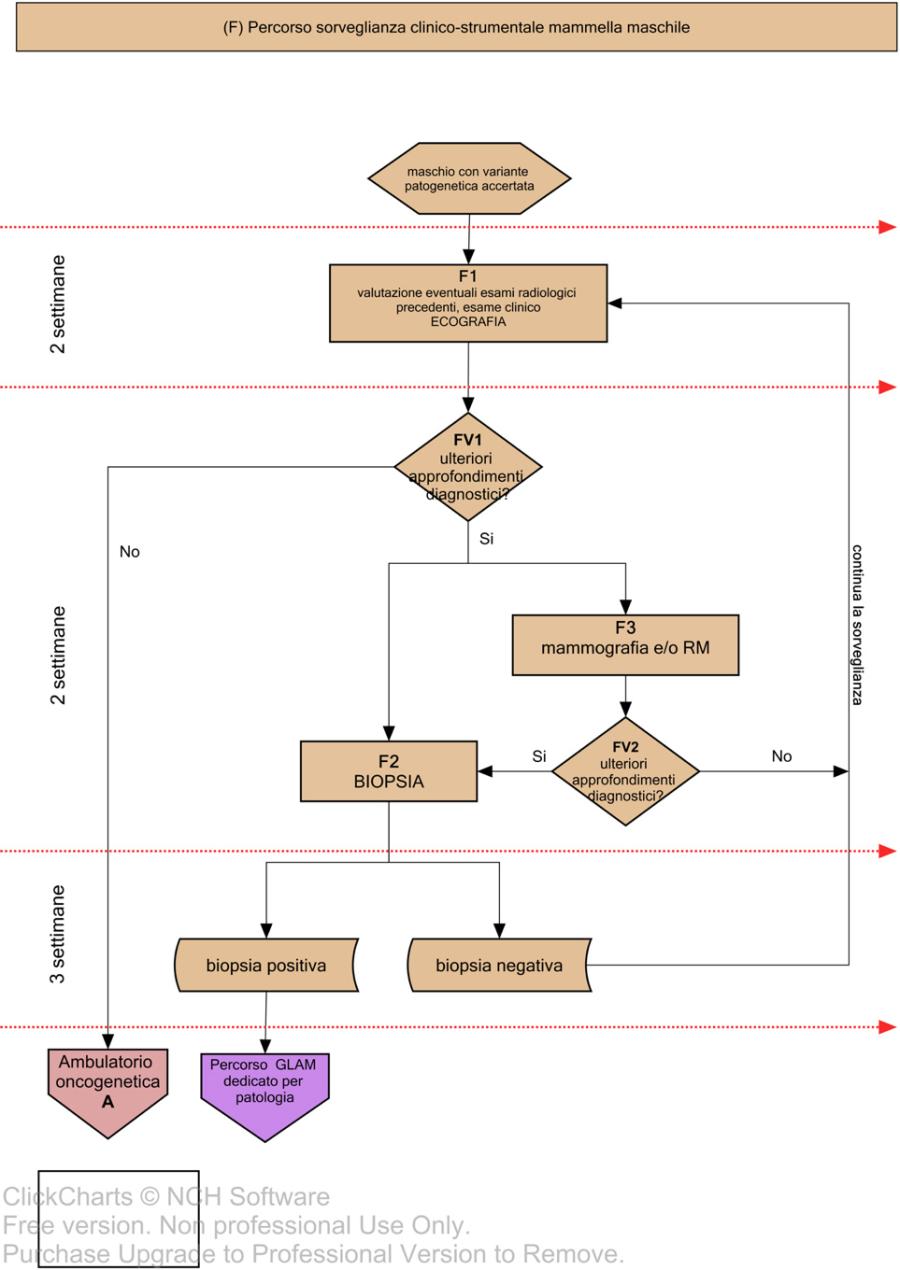
Ai soggetti di sesso maschile, portatori di varianti patogenetiche, è dedicato un percorso specifico rappresentato nella Fig 4, F.
A tutti i soggetticon o senza variante patogenetica accertata che verranno presi in carico, verrà offerto un percorso psiconcologico (Fig.2, G) che è trasversale a tutte le fasi del PDTA, finalizzato alla gestione dell’impatto psicologico all’esito del test, al cambiamento di vita, all’alterazione delle dinamiche familiari e facilitante il processo decisionale sulla scelta di strategia di gestione e/o riduzione del rischio.
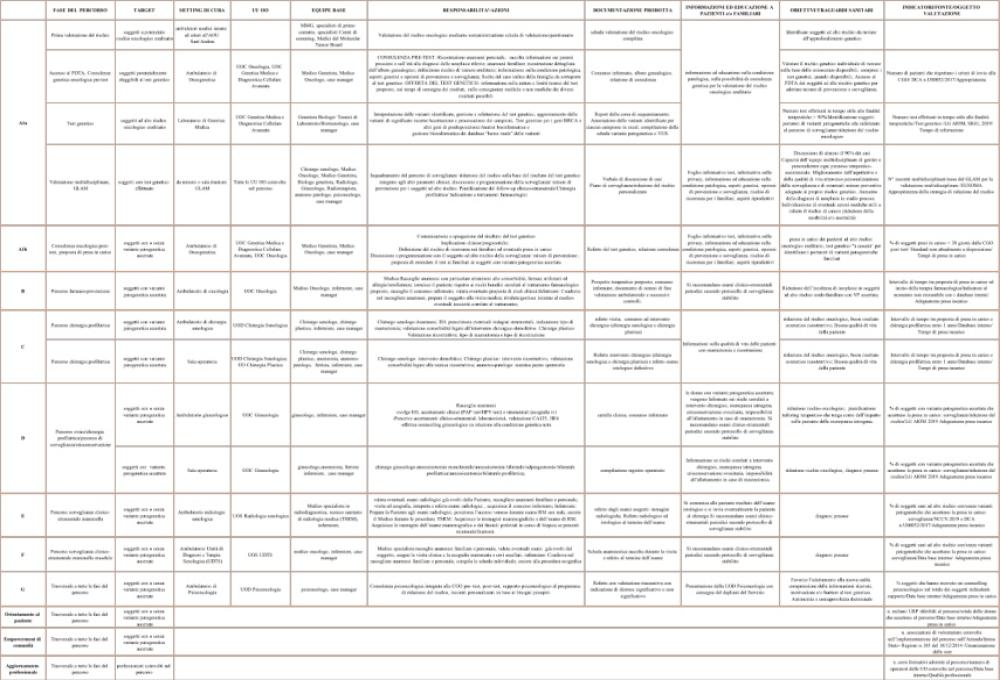
Nella Tabella 2 sono descritte tutte le fasi del PDTA con i setting di cura, i principali operatori sanitari coinvolti, le responsabilità, la documentazione prodotta in ogni fase, il materiale formativo ed educativo proposto al soggetto interessato ed ai relativi familiari, egli indicatori utilizzati per le azioni di miglioramento da programmare.
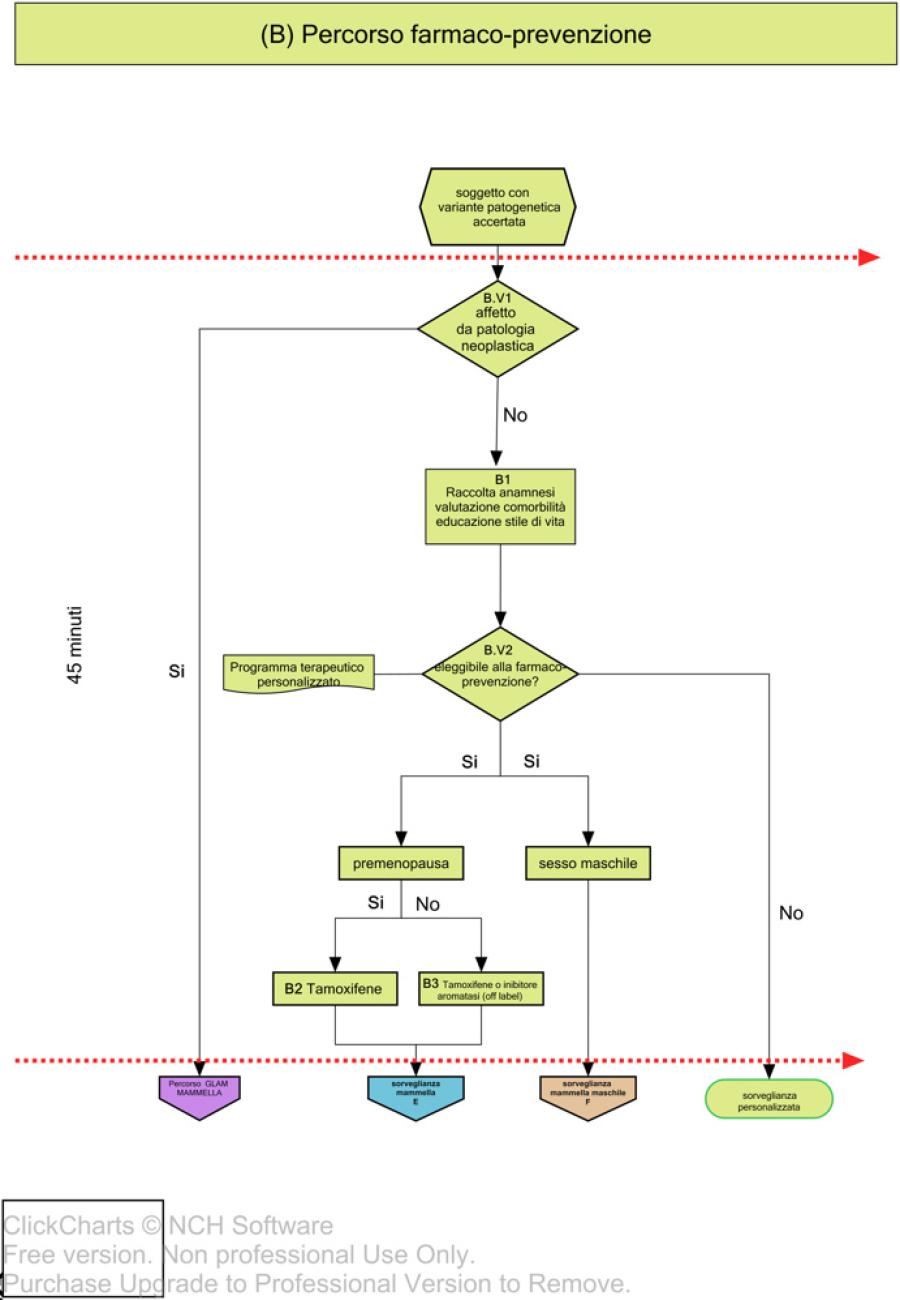
Nelle figure 3 e 4 vengono invece descritti i relativi percorsi di gestione e riduzione del rischio; in particolare, vengono riportate le flow charts relative alla farmaco-prevenzione (B), chirurgia profilattica mammaria (C), percorso ovaio (D), percorso di sorveglianza clinico-strumentale mammella (E) e percorso di sorveglianza clinico-strumentale mammella maschile (F)
Discussione
In questo documento viene descritto il PDTA, redatto nella AOU Sant’Andrea di Roma, per l’identificazione e la relativa gestione integrata di soggetti sani o con precedente diagnosi di tumore della mammella/ovaio, portatori di varianti patogenetiche germinali dei geni BRCA1/2 o altri geni di predisposizione. I dati epidemiologici sull’incidenza dei tumori ereditari della mammella indicano che la conoscenza dello stato di portatore di mutazioni in geni di predisposizione è uno strumento utile ai fini della prevenzione. I soggetti portatori possono beneficiare di terapie specifiche ed entrare a far parte di percorsi organizzati per la gestione del rischio genetico. A tale scopo, i PDTA sono strumenti utili per disegnare e strutturare processi assistenziali complessi centrati sui bisogni di questi pazienti, che facilitano e promuovono la qualità delle cure [14]. In Italia, accanto ai programmi di screening dedicati alle donne a basso rischio di tumore della mammella, sono poche le regioni che hanno costruito PDTA oncologici dedicati ai tumori ereditari. Una spinta in questa direzione è stata data dalla Regione Emilia-Romagna che nel 2014 ha formalizzato il “Protocollo assistenziale nelle donne a rischio ereditario di tumore della mammella e/o ovaio” [8], diventato successivamente un documento di riferimento per la realizzazione dei percorsi dedicati ai tumori ereditari mammella/ovaio. La Regione Lazio con il DCA n. U00191 del 14/05/2015 ha approvato il Documento Tecnico per i "Programmi di Screening Oncologici e successivamente, con il DCA 52/2017 ha invitato le Aziende Sanitarie a verificare la possibilità di attuare PDTA dedicati alla gestione delle donne ad alto rischio. In uno studio condotto nel 2015 dal gruppo di lavoro AIOM-AIRTUM, nella regione Lazio sono stati stimati 58.940 casi di tumore della mammella femminile [15]; considerando una frazione di casi ereditari del 5-10%, il numero di donne affette da tumore della mammella portatrici di varianti patogenetiche a carico di geni predisponenti è stimabile in 2.947-5.894 casi. Nonostante i dati riportati, nella regione Lazio, non ci sono Aziende Sanitarie che abbiano recepito e formalizzato le indicazioni del DCA 52/2017 per la gestione delle donne ad alto rischio. In questo scenario, nella AOU Sant’Andrea, è in corso di approvazione il PDTA dedicato ai tumori eredo-familiari mammella-ovaio che è stato redatto tenendo conto del contesto aziendale, delle risorse umane, tecnologiche, organizzative ed economiche. Il percorso di cura inizia con l’invio alla consulenza genetica oncologica dei soggetti, considerati a potenziale rischio oncologico ereditario. In sede di CGO viene rivalutato il profilo di rischio e se sussistono le condizioni viene proposto il test genetico. Il risultato del test consente di stabilire il rischio oncologico e di avviare la presa in carico del soggetto ad alto rischio in un programma di gestione del rischio personalizzato. Il ridisegno dell’iter assistenziale presente nella AOU ha inoltre lo scopo di assicurare il miglioramento dell’accessibilità e continuità delle cure, e l’adattamento delle linee guida scientifiche internazionali al contesto aziendale, al fine di ridurre le inappropriatezze cliniche e organizzative. Parte integrante della corretta strutturazione del PDTA sarà la valutazione dei processi e degli esiti mediante il monitoraggio annuale di indicatori specifici per ogni fase del percorso, finalizzato alla successiva attuazione di ulteriori azioni correttive e di miglioramento
Note
1. AIRTUM, «Intermedia EDITORE, BRESCIA, 2020. I numeri del cancro in Italia 2020.
2. Miki Y, Swensen J, Shattuck-Eidens D, Futreal PA, Harshman K, Tavtigian S, et al., «A strong candidate for the breast and ovarian cancer susceptibility gene BRCA1,» Science.1994; (266): 66-71.
3. Tavtigian SV, Simard J, Rommens J, Couch F, Shattuck-Eidens D, Neuhausen S, et al., “The complete BRCA2 gene and mutations in chromosome 13q-linked kindreds,” Nat. genet., 1996; (3): 333-337.
4. Maxwell KN, Domchek SM, Nathanson KL, and Robson ME. Population Frequency of Germline BRCA1/2 Mutations. J Clin Oncol. 2016 Dec;34(34):4183-4185
5. Chen S., Parmigiani G., «Meta-analysis of BRCA1 and BRCA2 penetrance.,» J Clin Oncol. 2007; n. 25, pp. 1329-1333.
6. Mavaddat N, Peock S, Frost D, Ellis S, Platte R, Fineberg E, , et al, and EMBRACE., «Cancer risks for BRCA1 and BRCA2 mutation carriers: results from prospective analysis of EMBRACE.,» J Natl Cancer Inst. 2013:(105) 812-22.
7. Taylor A, Brady AF, Frayling IM, Hanson H, Tischkowitz M,Turnbull C, Side L; UK Cancer Genetics Group (UK-CGG). Consensus for genes to be included on cancer panel tests offered by UK genetics services: guidelines of the UK Cancer Genetics Group., « J Med Genet. 2018: (6) n. 55: 372-37.
8. Protocollo assistenziale nelle donne a rischio ereditario di tumore della mammella e/o ovaio Regione Emilia‐Romagna, II edizione, Anno 2016
9. DCA N.U000189/2017. Programma Operativo 2016-2018 (DCA 52/2017) Approvazione documento di indirizzo per la prevenzione secondaria del tumore al seno, gestione delle donne ad alto rischio e follow-up delle donne post-trattamento
10. Deming, W.E. Out of the Crisis, 1st ed.; MIT Press: Cambridge, MA, USA, 2000.
11. McCarthy Veach P, Bartels DM, LeRoy BS. 2007. Coming Full Circle: A Reciprocal-Engagement Model of Genetic Counseling Practice. Journal of Genetic Counseling; 16:713-728.
12. «Istituzione della rete specialistica disciplinare dei Laboratori di Genetica Medica in attuazione dei Programmi Operativi 2013-2015. Approvazione del documento relativo alla "Rete dei laboratori di Genetica Medica della Regione Lazio"»
13. NCCN guidelines, Genetic/Familial High-Risk Assessment: Breast and Ovarian, 2020
14. Vanhaecht K, Panella M, van Zelm R, Sermeus W. An overview on the history and concept of care pathways as complex interventions. International Journal of Care Pathways. 2010: 14(3), 117– 123.
15. AIOM-AIRTUM. I numeri del cancro in Italia, 2016